高校物理の原子の定義・法則などをまとめました。勉強に役立ててもらえれば幸いです。
原子
高校物理の「原子」とは
高校物理の「原子」とは
原子とは、物質の基本的な構成要素の一つであり、化学的な反応において化学的な性質を示す最小単位である。高校物理の「原子」では原子の構造、原子を構成する電子・原子核、粒子性や波動性などの量子力学の基礎を勉強する分野である。
原子
原子「原子」とは物質の基本的な構成要素の一つであり、化学的な反応において化学的な性質を示す最小単位。
例えば大気にある酸素 (酸素分子 O\(_2\))は2つの酸素原子 Oで構成される。
原子構造 (ラザフォードの原子模型)
原子構造 (ラザフォードの原子模型)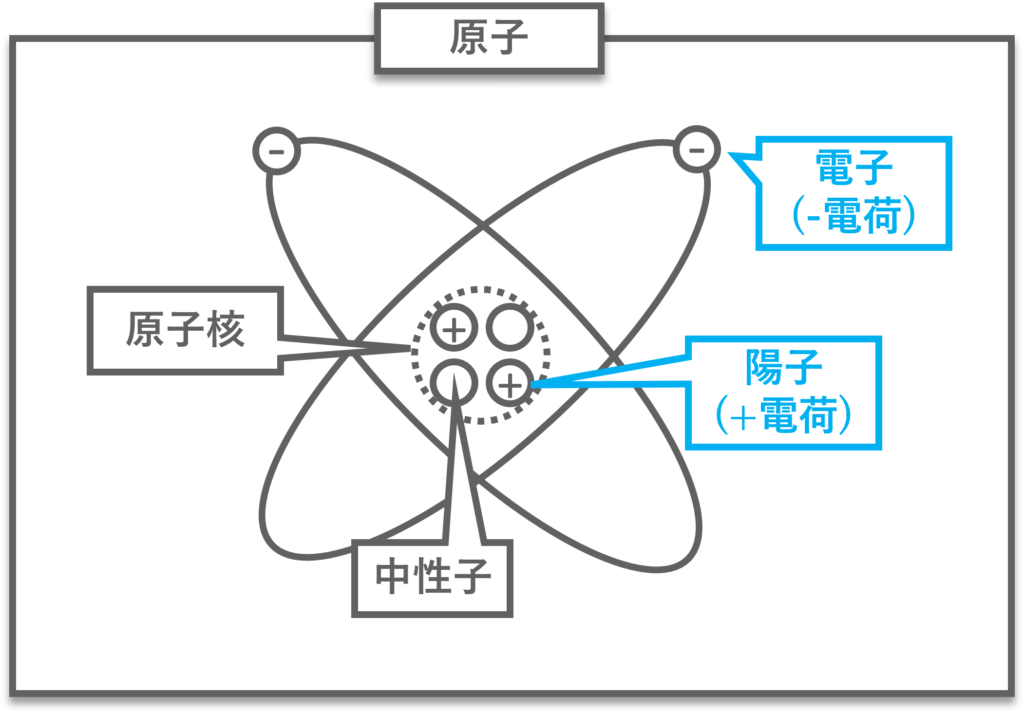
原子はマイナスの電気量を持つ「電子」とプラスの電気量を持つ「原子核」で構成される。原子核はさらにプラスの電気量を持つ「陽子」と電気量を持たない「中性子」で構成される。
この通常の状態では電子の数と陽子の数は同じで原子としては電気量が0の状態。
この原子模型は「ラザフォードの原子模型」と呼ばれ、その他には「トムソンの原子模型」や「長岡の原子模型」などが提案されたが、「ラザフォードの原子模型」だけが実験結果をうまく説明することができた。
電子
電子
電子
電子とは、負の電荷をもつ非常に軽い粒子で、原子の外側に存在する。電流や化学結合などは、主に電子の振る舞いによって決まる。
ただし、電子に高いエネルギーを与えたりすると原子に拘束されていた電子が原子が飛び出すことがある。
陰極線
陰極線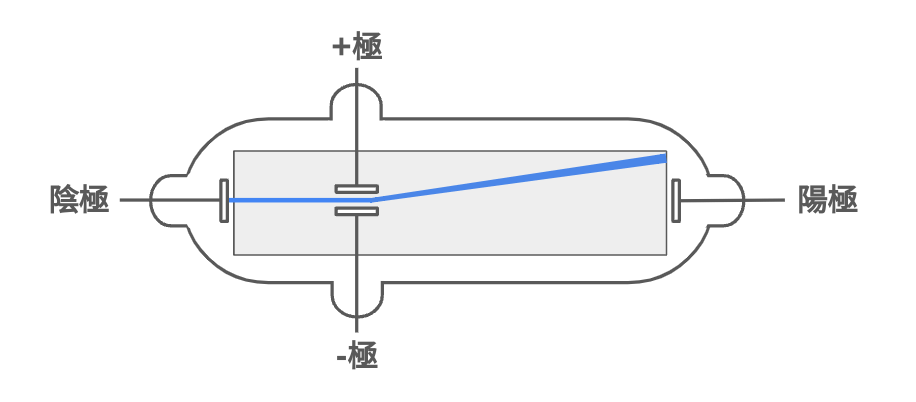
「陰極線」とは真空管などで観測できる電子のビーム (電子ビーム)のことである。この電子ビームは負極(陰極)から発生して陽極方向へ加速されながら移動をする。
加速された電子が蛍光物質に衝突すると、そのエネルギーを放出して蛍光を発する。
トムソンの実験と比電荷
トムソンの実験と比電荷トムソンは、陰極線が電場や磁場で曲がる様子を調べ、電子の比電荷 e/m を測定した。
これにより、電子が非常に軽い粒子であることが分かった。
ミリカンの油滴実験と電気素量
ミリカンの油滴実験と電気素量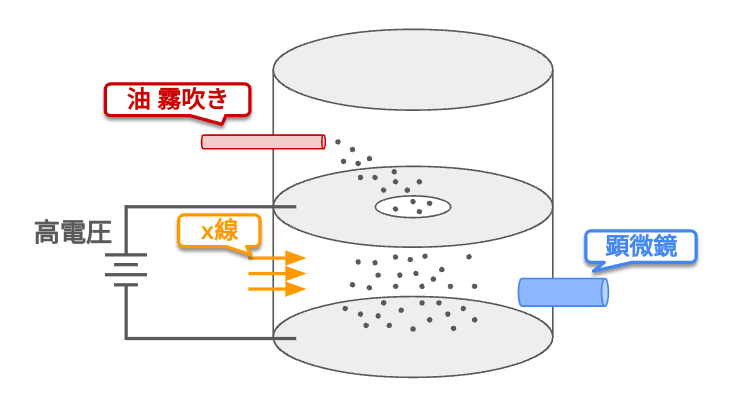
「ミリカンの油滴実験」は電子の電気量 (電気素量)を求める実験である。
この実験では電場がかかっている場所に霧吹きで油滴を作って、さらにその油滴に電荷を与えることで重力と電場によってかかる力が釣り合って油滴が空気中に浮かぶ。この状態で電界をなくすと油滴は落下する。このときの油滴の速度を観測することで油滴に与えられた電気量がわかる。
この実験の何度も繰り返すと電気量がある値の整数倍になることを発見した。この電気量の最小単位が「電気素量」で、この実験から電子の電気量 (電気素量)を求めることができた。
原子核
原子核
原子核
改めてになるが原子はマイナスの電気量を持つ「電子」とプラスの電気量を持つ「原子核」で構成される。原子核はさらにプラスの電気量を持つ「陽子」と電気量を持たない「中性子」で構成される。
ちなみに原子核は電子の10万分の1程度の大きさである。
原子番号・質量数
原子番号・質量数原子番号とは、原子核中の陽子の数であり、元素の種類を決める。
質量数とは、陽子数と中性子数の和である。
例えば炭素では原子番号が6、質量数は12で下記のような書き方をする (元素によって原子番号は固定だが、質量数は複数ある)。
炭素の原子記号:$$^{12}_6C$$
核力
核力
陽子は静電気で反発し合うのに原子核でまとまっているのは「核力 (かくりょく)」と呼ばれる静電気以外の力が働いているためである
同位体
同位体同じ元素では陽子の数は同じだが、質量数は異なる原子がある。これは同じ元素でも中性子の数が違うことがあるためである。それらは同位体と呼ばれ、天然で存在する同位体の比率はほとんど一定である。
ボーアの理論
水素原子のスペクトル
水素原子のスペクトル連続スペクトルは、白熱電球や太陽の光のように、すべての色が連続して見えるスペクトルである。
これに対して、水素原子のスペクトルは「線スペクトル」と呼ばれ、特定の色の線が見える。ボーアの理論によると、水素原子の電子は特定のエネルギーレベルにしか存在できない。電子が高いエネルギーレベルから低いエネルギーレベルに移動するとき、特定の色の光を放出する。この光の色は、電子が移動するエネルギーレベルの差によって決まる。
ボーアの理論
ボーアの理論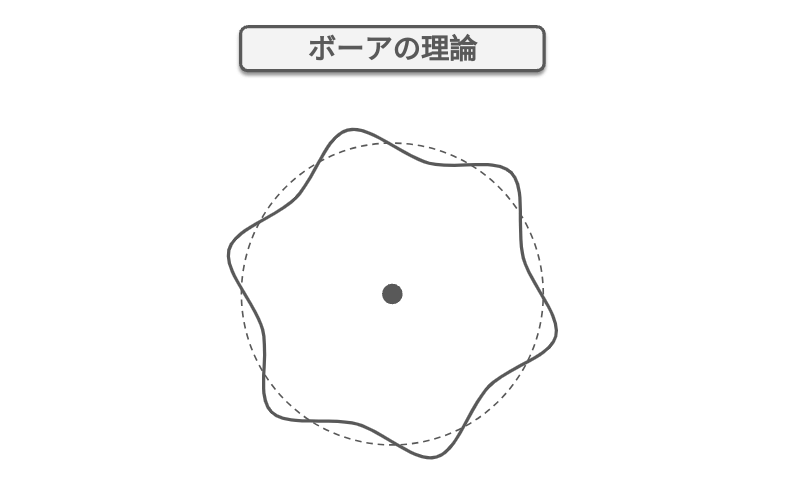
ボーアの理論は、水素原子の電子が特定の軌道を回ることを説明する。この軌道は「エネルギー準位」と呼ばれ、各エネルギー準位には特定のエネルギーがある。電子は通常、低いエネルギー準位にいるが、エネルギーを吸収すると高いエネルギー準位に移動をする。
ボーアの理論では「量子条件」が使わる。量子条件とは、電子が回る軌道が特定の離散的な値をとることで、電子は連続的にエネルギーをとるのではなく、特定のエネルギー準位のみに存在する。
まとめ
本記事では高校物理の「原子」の定義や法則をまとめました。
原子の理解は物質の基本的な性質や挙動を理解する上で不可欠です。原子の構造や性質を学ぶことで、化学反応や物質の相互作用を理解し、新しい物質を設計したり、現象を説明したりすることが可能になります。また、原子の知識はエネルギーの生成や利用、素粒子物理学など、さまざまな科学分野に応用されます。
本記事で少しでも高校物理の「原子」の学習に役立てていたら幸いです。
その他の高校物理まとめは下記の黄色い枠のリンクから↓